肺癌,特别是非小细胞肺癌,一直是全球范围内致死率蕞高的癌症之一。KRAS突变被认为是癌症研究中的一大难题,多年来始终难以攻克。然而,随着索托拉西布(AMG 510)的出现,这一局面得到了改变。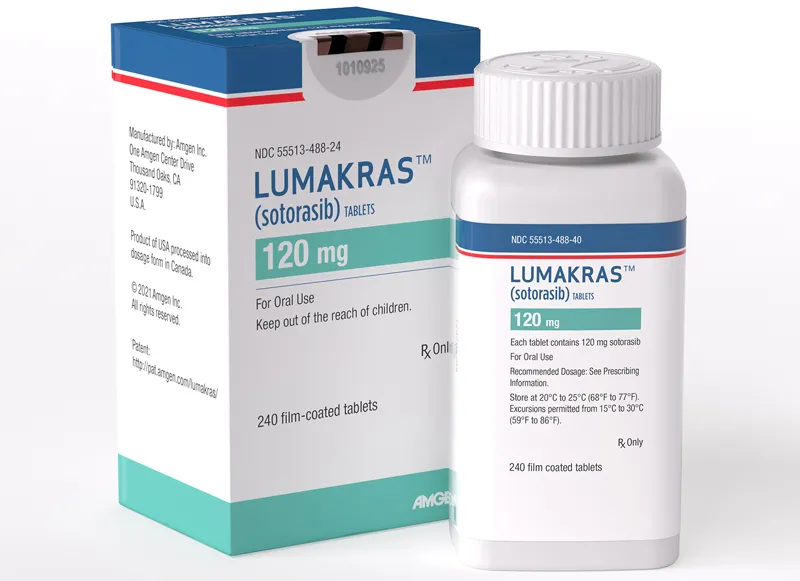
【研发代号】AMG 510
【通用名】Sotorasib
【中文名】索托拉西布
【商品名】Lumakras
【给药方式】口服片剂
【获批日期】2021年5月28日
【获批机构】美国食品药品监督管理局(FDA)
【获批适应症】已接受过至少一次系统性治疗但病情仍然进展或不耐受的KRAS G12C突变型非小细胞肺癌患者
作为全球头一款靶向KRAS G12C突变的创新药物,索托拉西布(AMG 510)为许多非小细胞肺癌患者带来了新的治疗希望。索托拉西布(AMG 510)为什么对肺癌患者来说意义重大?目前虽已在美国上市,但仍未在中国上市,国内患者又该如何用上?本文进行详细解读。
索托拉西布(AMG 510)是由美国安进公司(Amgen)研发的全球头一个专门针对KRAS G12C突变的小分子抑制剂。KRAS突变在癌症患者中非常常见,尤其是在非小细胞肺癌患者中,约有13%的患者携带KRAS G12C突变。在健康细胞中,KRAS基因会产生一种名为KRAS的蛋白质,该蛋白质起着分子开关的作用,循环在“开”和“关”之间,以保持细胞生长受到一定的控制。但是在具有G12C突变的人群中,开关比正常情况下更长时间地停留在“开”的位置,这使得细胞无法受到控制地生长。这种不受控制的细胞生长就会导致癌症的发生。索托拉西布(AMG 510)则通过一种简单而有效的方式来对抗肿瘤。我们可以这样来理解它的作用原理:它专门寻找并粘附在一种叫做KRAS G12C的蛋白质上,这种蛋白质在某些癌症患者的体内是“坏蛋”的角色,负责发出让癌细胞不断生长的信号。索托拉西布(AMG 510)就像一个“开关”,它一旦与KRAS G12C蛋白结合,就能关闭这个蛋白质的信号,从而阻止癌细胞继续生长和扩散。索托拉西布(AMG 510)主要适用于已接受过至少一次系统性治疗但病情仍然进展或不耐受的KRAS G12C突变型非小细胞肺癌患者。传统治疗手段对这类患者通常效果有限,而索托拉西布(AMG 510)为他们提供了一个新的治疗选择。
2021年5月28日,美国食品药品监督管理局(FDA)授予索托拉西布(AMG 510)加速批准,用于治疗携带KRAS G12C突变的局部晚期或转移性非小细胞肺癌成人患者,患者已经接受过至少一种系统性治疗。
在促使索托拉西布(AMG 510)获批的CodeBreaK 100临床试验中:该试验是一项多中心、单臂、开放标签的2期临床试验,研究人员在124名具有KRAS G12C突变的局部晚期或转移性非小细胞肺癌患者中,评估了索托拉西布(AMG 510)的疗效,这些患者的病情在接受过至少一种系统性治疗后仍有进展。患者每天口服960毫克索托拉西布(AMG 510),直至疾病进展或出现不可接受的毒性。- 索托拉西布(AMG 510)治疗共取得了36%的客观缓解率,即有36%的患者肿瘤大幅缩小或消失。
- 58%的患者缓解持续时间至少为6个月,证明该药疗效持久。
索托拉西布(AMG 510)治疗蕞常见的不良反应(发生率≥ 20%)包括腹泻、肌肉骨骼疼痛、恶心、疲劳、肝损伤和咳嗽。如果患者治疗过程中出现间质性肺病症状,需暂停用药;如果确诊为间质性肺病,则需停药。蕞常见的实验室异常(发生率≥ 25%)包括淋巴细胞减少、血红蛋白减少、天冬氨酸氨基转移酶升高、丙氨酸氨基转移酶升高、钙减少、碱性磷酸酶升高、尿蛋白增加和钠减少。患者在服药期间,不良反应和实验室异常都应特别关注,进行密切监测。
索托拉西布(AMG 510)是全球头个靶向KRAS突变的抗癌药物,打破了近40年来KRAS“不可成药”的历史。美国MD安德森癌症中心的Ferdinandos Skoulidis博士(他是索托拉西布(AMG 510)1期临床试验的领导者)表示:“G12C突变类肿瘤非常难治,在索托拉西布(AMG 510)获批之前,患者的标准疗法是化疗,但化疗只能帮助患者延长几个月的生命,并且会引发严重的副作用。患者在接受一线标准化疗和免疫疗法后,预后仍然很差,急需有效的治疗选择。索托拉西布(AMG 510)的获批,对于KRAS G12C突变型非小细胞肺癌患者来说,是一项重大的里程碑,使得原本没有任何治疗选择的他们从此有了针对性的治疗方案。同时,与化疗相比,索托拉西布(AMG 510)不仅能更有效地控制病情,副作用也相对少得多。”美国MD安德森癌症中心的David Hong博士(他是索托拉西布(AMG 510)2期临床试验的领导者)表示:“KRAS突变已经被发现超过30年了,但由于其表面异常光滑,无法将药物附着到上面,因此一直‘不可成药’。索托拉西布(AMG 510)的出现,打破了这一困局,通过利用先前隐藏的凹槽成功锁定KRAS并与其相结合,实现了药物附着。索托拉西布(AMG 510)也因此成为了全球头一款能够直接针对KRAS突变的治疗方法。”
目前,索托拉西布(AMG 510)已在美国获批上市,但仍未在中国获批上市。好消息是:索托拉西布(AMG 510)已作为“特许药”,落地海南博鳌乐城国际医疗旅游先行区。意味着国内患者只要符合用药资格,在海南即可用上该药。
来源:人民网-海南频道
乐城国际医疗旅游先行区管理局供图
而位于海南博鳌乐城国际医疗旅游先行区的海南盛诺一家诊所,就可以帮助国内患者用上索托拉西布(AMG 510)。海南盛诺一家诊所成立于2020年,是正式获得海外新药急需进口申请资格的规范医疗机构。自成立以来,诊所已帮助大量国内患者“快人一步”用上了多款海外已上市、但国内尚未获批的新药、特效药。
?国内患者通过海南盛诺一家诊所使用索托拉西布(AMG 510)实例,在人民网-海南频道进行过公开报道:60岁的周先生是一名与癌症抗争多年的患者。十年前,他被确诊为左肺低分化腺癌,伴肺门淋巴结转移,接受了肺癌根治术,切除掉了整个左肺。术后他又接受了辅助化疗和放疗,以降低复发几率。然而,2021年他的癌症还是复发了。周先生在接受了放疗之后,病情仍不断恶化,癌症广泛且快速地进展。鉴于周先生此前的基因检测结果显示具有KRAS G12C突变,医生向他推荐了一款新的靶向药索托拉西布(AMG 510)进行后续治疗。当时索托拉西布(AMG 510)还未在国内获批上市,以往对于这样的情况,患者只能选择出国治疗。但周先生的儿子找到了有着对海外新药“先行先试先用”特许政策的博鳌乐城国际医疗旅游先行区,在海南盛诺一家诊所的帮助下,于2022年1月成功用上了索托拉西布(AMG 510)。每天一次,每次960mg。用药后,周先生感觉身体状况明显好转,并且没有出现较大的副反应。在持续用药过程中,他之前呼吸困难、癌痛、乏力、消瘦等症状明显改善,体重增加了4Kg。同时,胸部CT检查提示:右肺部癌灶、胸水、心包积液、肋骨转移灶、纵膈转移性淋巴结均得到良好控制。?如果您也想像周先生一样,在海南博鳌乐城国际医疗旅游先行区使用索托拉西布(AMG 510),可在线联系我们,将有海南盛诺一家诊所专人为您解答更多用药详情。- 能否使用索托拉西布(AMG 510),需要先经由专门的评估,可通过提供患者的病历资料等进行线上评估;
- 使用该药,务必患者本人到海南才能使用,有着严格的用药流程,不可邮寄或家属代领;
- 该药的具体用法与用量等,需由专业医生根据患者病情进行评定。
参考资料:
[1]https://www.fda.gov/drugs/resources-information-approved-drugs/fda-grants-accelerated-approval-sotorasib-kras-g12c-mutated-nsclc
[2]https://www.fda.gov/news-events/press-announcements/fda-approves-first-targeted-therapy-lung-cancer-mutation-previously-considered-resistant-drug
[3]https://www.multivu.com/players/English/8812853-amgen-fda-approval-lumakras-sotorasib-targeted-kras-g12c-lung-cancer/
[4]https://www.mdanderson.org/cancerwise/what-it-meant-for-sotorasib-a-drug-i-tested-in-clinical-trials-for-non-small-cell-lung-cancer-to-receive-FDA-approval.h00-159466368.html
[5]https://www.mdanderson.org/cancerwise/tumor-profiling-gives-lung-cancer-patient-a-targeted-therapy-option-and-more-time.h00-159383523.html
[6]http://hi.people.com.cn/n2/2022/0413/c231190-35219894.html
【盛诺一家】成立于2011年,是国内权威的海外医疗咨询服务机构,提供出国看病、全球专家远程咨询、日本体检等服务。
海外医疗服务为什么选择盛诺一家?
- 与美、日、英近 50家 顶级医院官方签约合作
- 服务团队 70% 具医学背景,专业可靠
- 全球 15个 服务中心,全流程一站式服务
- 医疗费用享 5%-40% 专属折扣
- 60%客户通过老客户推荐,满意度高达 99%
如果您或家人想了解海外就医方案?
📞 请拨打免费咨询热线:400-855-7089 或通过
🌐 盛诺一家官网 预约咨询,获取专业建议,开启全球精准医疗之路。
本文为海外就医科普文章,内容仅供阅读参考,不作为任何疾病治疗的指导意见。文章由盛诺一家编译,版权归盛诺一家公司所有,转载或引用本网内容须注明“转自盛诺一家官网(www.stluciabj.cn)”字样。