近期一条来自海外监管的消息,让不少移植科医生和患者家庭都眼前一亮——
美国食品药品监督管理局(FDA)批准YARTEMLEA(通用名:narsoplimab-wuug),用于治疗造血干细胞移植相关血栓性微血管病,覆盖成人及两岁及以上儿童。
这也是首个美国批准的“造血干细胞移植相关血栓性微血管病”治疗药物。
(来源:indianpharmanetwork.in)
什么是“造血干细胞移植相关血栓性微血管病”?
如果你对这个病名感到陌生,非常正常:它不常被大众讨论,却常常出现在血液肿瘤患者“艰难的一段路”——造血干细胞移植之后。
其特点是进展快、风险高,还容易和感染、药物反应等混在一起,耽误治疗窗口,是移植后相当凶险的并发症之一。
你这样理解它:身体的细小血管受了伤,血液在里面更容易形成很多“微小血栓”,于是器官供血被影响。
而且,它往往不是一个“单点故障”,而像连锁反应:
血管内壁受损后,血小板被消耗得更快,所以可能出现血小板下降;
红细胞在受损的血管里被“剪碎”,出现溶血相关异常;
肾脏这种“血流密集又精细”的器官容易先吃亏,表现为肾功能恶化、蛋白尿;
还可能合并高血压、神经系统症状等。
(来源:pidrug.com)
更麻烦的是:移植后本来就可能出现感染、药物不良反应、移植物攻击宿主反应等问题,它们的表现也可能牵扯到血小板、肾功能、贫血。
于是,这种微血管病很容易被当成“移植后的一般波动”,而不是一个需要专门识别和尽早干预的并发症。
所以对家属来说,重要的不是背下术语,而是形成一个警觉:
移植后如果出现“血小板持续下降+溶血线索+肾损伤/蛋白尿+血压升高”等组合信号,一定要让移植团队明确评估是否符合这种并发症的诊断框架。
这种病和血液肿瘤为什么高度相关?
因为很多血液肿瘤患者必须走过移植这座“高山”。
在血液肿瘤(比如某些类型的白血病、淋巴瘤、骨髓瘤等)治疗中,造血干细胞移植是关键策略之一。
(来源:stemcelltherapydelhi.wordpress.com)
移植像“重建一套新的造血与免疫系统”,但这条路并不轻松:预处理方案、免疫抑制药物、感染、移植物攻击宿主反应等因素叠加,会对血管内壁造成持续压力。
中国专家共识也指出:这种微血管病并发症的发生,与多因素内皮损伤及免疫系统异常激活有关。据《二〇二一年版专家共识》:国内报道异基因造血干细胞移植后,这类并发症发生率约为4%。
但要提醒一句:由于不同中心使用的诊断标准、筛查强度和记录方式不一,真实发生率可能存在低估或漏诊问题——这也是近年国际共识一直在推动标准化诊断框架的原因。
过去相当长时间里,这类并发症的治疗更像“拼图”:支持治疗(血压、液体管理、肾脏支持)、处理感染、调整免疫抑制方案、评估是否存在免疫系统异常激活等,更多依赖各中心经验与个体化判断。
近年来,随着研究发现“补体系统”(可以理解为免疫防御的某套自动启动机制)在其中可能扮演关键角色,临床上出现了针对这条通路的治疗探索。
而现在,YARTEMLEA的获批重要的意义就在于:让这一领域第一次从“经验探索”,有了明确写在药品说明书里的适应证与用药路径。
YARTEMLEA是款什么药?有效性如何?
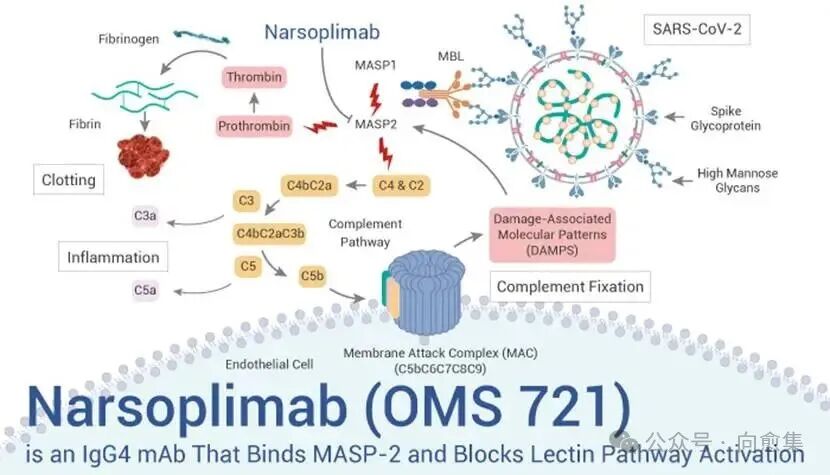
这款药的思路并不复杂:它瞄准的是免疫系统里一条可能被“过度点燃”的通路。
YARTEMLEA属于单克隆抗体药物,作用点是补体系统“凝集素通路”的关键环节(通俗说:把某个过度放大的“报警开关”按下去)。
(来源:immune-system-research.com)
根据FDA的说明书,其获批主要证据来自:一项单组、开放研究(28名成人患者);以及扩展用药项目里可评估的19名患者(含成人与儿童)。
说明书里对“反应”的定义也比较严格:不是“某个指标好看了”就算,而是要求血栓性微血管病相关的关键实验室指标改善,并伴随器官功能改善或摆脱输血依赖。
结果显示:
在28名成人患者研究中,达到反应的比例约为六成;
在扩展用药项目可评估的19名成人及儿童患者中,反应比例接近七成;
从诊断时点算起的100天生存率,在这两组中都超过七成。
你可以这样理解:在一个“进展快、风险高、过去缺少明确获批药物”的并发症上,能看到相对一致的反应比例与短期生存改善信号,本身就是巨大的进步。
当然,也要实事求是地告诉读者:目前证据主要来自单组研究与扩展用药数据,学术界也有外部对照分析来补强,但它并不等同于经典的随机对照试验。
此外,说明书也明确提醒:作为影响补体系统的药物,可能增加严重感染风险,必须由移植团队在严密监测下使用。

生产YARTEMLEA的美国生物制药公司Omeros
(来源:lifesciencewa.org)
对中国患者意味着什么?
首先,这条消息值得“带给你的移植团队看”。
很多家庭遇到并发症时,焦虑的不是“听不懂”,而是“不知道问什么”。把“美国已批准首个针对该并发症的药物”这件事告诉医生,至少能把讨论拉回到关键问题:
我们是否符合诊断?
属于哪一类风险?
有没有需要尽早干预的窗口?
其次,YARTEMLEA在美国获批,短期内不等于“国内可用”。
公开信息显示,这款药物已在美国正式获批,并计划2026年1月在美国商业化可及;目前未见其在中国获批的权威公开信息。美国刚刚获批的新药,一般需要等待数年才会在国内获批。
最后,如果想抢先使用,现实途径只有三条。
要么赴美就医、在美国合规医疗体系内接受评估与治疗;要么等待国内未来可能的注册与可及;要么关注国内是否出现与该疾病相关的规范临床研究机会(是否适合由移植中心评估)。

(来源:摄图网)
任何自行“找药用药”,在移植并发症场景下都可能带来不可逆的风险。
结语:
对于血液肿瘤患者来说,造血干细胞移植是一场“把命运推回正轨”的大工程,但它也可能引发一些进展极快的并发症。
如今,移植相关血栓性微血管病终于迎来首个美国批准药物,这是值得转发的好消息;同时,它也提醒我们:越是小众凶险的并发症,越需要标准化识别、尽早评估、规范治疗。
希望这条信息,能在关键时刻帮助更多家庭少走弯路——把问题问到点子上,把决策交给专业团队。
PS.这是一条可能“救命”的消息,请不吝转发。
参考来源:
1.美国食品药品监督管理局:YARTEMLEA说明书
2.Omeros公司公告:获批信息、美国商业化时间窗口、作用机制描述
3.中国专家共识:造血干细胞移植相关血栓性微血管病诊断与治疗
4.国际共识文件:提出更可操作的诊断与风险分层框架
5.学术发表:外部对照与扩展用药项目相关研究
【盛诺一家】成立于2011年,是国内领先的海外医疗咨询服务机构,至今已为近10000个患者家庭提供出国就医服务,重点涵盖癌症、心脏病、罕见疾病等重疾领域。凭借专业、贴心、高效的服务,盛诺一家赢得了99%客户好评率!
📌为什么出国就医患者选择盛诺一家?
- 官方资质:与美国、日本、英国近50家TOP级医院签署官方合作协议,搭建全球医疗服务网络
- 专业可靠:咨询服务团队成员70%拥有医学背景,包括医学院博士、三甲医院医生、资深医学翻译
- 一站式服务:在全球设有15个客户服务中心,保障从国内到海外全流程、高品质的服务质量
- 客户至上:推出48小时冷静期、风险告知书、医疗费用“零加成”等措施,保障客户权益
- 专属折扣:通过本公司预约出国就医的患者,可额外申请5%–40%的医疗费用减免折扣
👉如果您或者家人需要出国看病,可拨打免费咨询热线 400-855-7089,或通过 盛诺一家官网 预约咨询!








