导读
FDA正式批准PD-L1抑制剂Durvalumab(度伐利尤单抗)与化疗联合使用,一线治疗局部晚期或转移性胆道癌患者。试验证明,该联合方案显著改善了患者的总生存期。
9月3日,美国FDA批准阿斯利康公司生产的PD-L1抑制剂Durvalumab与化疗方案吉西他滨和顺铂联用,治疗局部晚期或转移性胆道癌成年患者。
来源:摄图网
获批依据
此次获批基于一项名为TOPAZ-1的试验结果。这是一项随机、双盲、安慰剂对照、多区域试验,共招募了685名局部晚期或不可切除的转移性胆道癌患者,这些患者之前未接受过针对晚期疾病的全身药物治疗。
参与试验的患者中,56%为亚洲人,37%为白人,2%为黑人,4%为其他种族患者。其中,50%为男性,50%为女性。患者的平均年龄为64岁(20~80岁),47%为65岁或以上患者。56%患有肝内胆管癌,25%患有胆囊癌,19%患有肝外胆管癌。
患者按照1:1 随机分为两组,以下简称Durvalumab组和安慰剂组。
Durvalumab组:Durvalumab+吉西他滨和顺铂,21天为一个周期,蕞多8个周期,随后每4周使用一次Durvalumab维持治疗;
安慰剂组:安慰剂+吉西他滨和顺铂,21天为一个周期,蕞多8个周期,随后每4周使用一次安慰剂维持治疗。
两组患者在维持治疗期,持续使用Durvalumab或安慰剂,直至疾病进展或患者不可耐受。
主要疗效结果测量标准为总生存期。前24周每6周进行一次肿瘤评估,之后每8周进行一次肿瘤评估,直至确认客观疾病进展。
试验结果证明,与接受安慰剂+吉西他滨和顺铂的患者相比,Durvalumab组患者的总生存期出现改善。
详情如下:
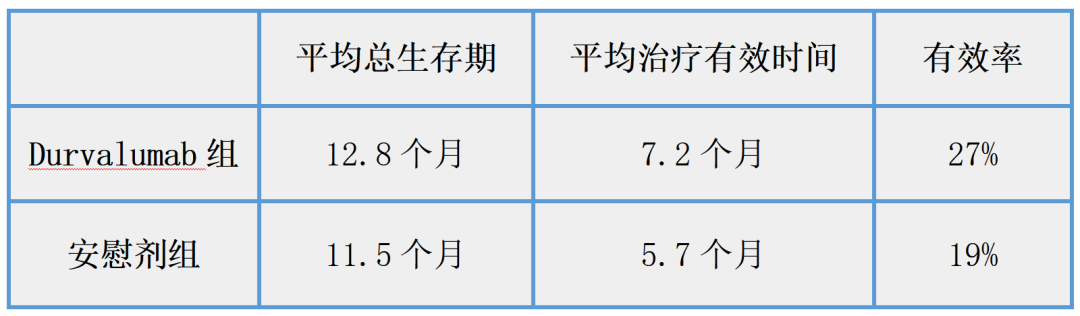
患者蕞常见的不良反应为疲劳、恶心、便秘、食欲下降、腹痛、皮疹和发热。
延伸阅读[1]:
胆道癌是发生在胆管和胆囊中一种罕见且具有侵袭性的癌症,在中国和泰国更为常见,全球每年约有21万人被诊断出患有胆道癌,但由于早期胆道癌几乎没有症状,因此导致大多数患者确诊时已是晚期,治疗选择有限并且预后较差。
Durvalumab是一种人源单克隆抗体,可与PD-L1蛋白结合,阻断PD-L1与PD-1和CD80蛋白的相互作用,对抗肿瘤的免疫逃避策略,并解除对免疫反应的抑制。
此前Durvalumab已获批作为免疫疗法,用于非小细胞肺癌(NSCLC),已在美国、欧盟、日本、中国和许多其他国家获批,还在几个国家获批治疗晚期膀胱癌,使大批癌症患者获益。
2020年12月,Durvalumab在美国获得孤儿药认定,用于治疗胆道癌患者。
此次Durvalumab正式获批,将为更多胆道癌患者带来治疗新希望。
来源:
本文编译自FDA官网2022年9月2日发布的《FDA approves durvalumab for locally advanced or metastatic biliary tract cancer》一文,原文链接:
https://www.fda.gov/drugs/resources-information-approved-drugs/fda-approves-durvalumab-locally-advanced-or-metastatic-biliary-tract-cancer?utm_medium=email&utm_source=govdelivery
参考资料:
[1]https://www.astrazeneca.com/content/astraz/media-centre/press-releases/2021/imfinzi-improved-survival-in-biliary-tract-cancer.html
本文由盛诺一家原创编译,转载需经授权
【盛诺一家】成立于2011年,是国内领先的海外医疗咨询服务机构,至今已为近10000个患者家庭提供出国就医服务,重点涵盖癌症、心脏病、罕见疾病等重疾领域。凭借专业、贴心、高效的服务,盛诺一家赢得了99%客户好评率!
📌为什么出国就医患者选择盛诺一家?
- 官方资质:与美国、日本、英国近50家TOP级医院签署官方合作协议,搭建全球医疗服务网络
- 专业可靠:咨询服务团队成员70%拥有医学背景,包括医学院博士、三甲医院医生、资深医学翻译
- 一站式服务:在全球设有15个客户服务中心,保障从国内到海外全流程、高品质的服务质量
- 客户至上:推出48小时冷静期、风险告知书、医疗费用“零加成”等措施,保障客户权益
- 专属折扣:通过本公司预约出国就医的患者,可额外申请5%–40%的医疗费用减免折扣
👉如果您或者家人需要出国看病,可拨打免费咨询热线 400-855-7089,或通过 盛诺一家官网 预约咨询!








