本文由盛诺一家原创编译,转载需经授权
摘要
近日,澳大利亚Kazia Therapeutics公司公布了一项1b期临床试验中头一位患者的初步结果。该试验评估了新药Paxalisib联合免疫治疗药物帕博利珠单抗(Keytruda)与标准化疗组成的联合方案,针对转移性三阴性乳腺癌患者的疗效。
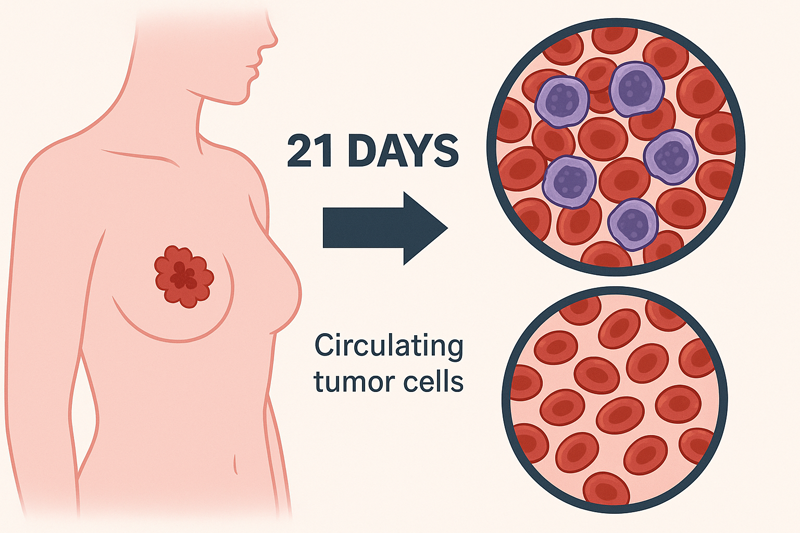
一名61岁的晚期三阴性乳腺癌女性患者,她的癌症已转移到肺部,在完成头一个周期(21天)的治疗后,取得了令人振奋的初步疗效:
循环肿瘤细胞(CTCs)减少超过50%,CTCs是血液中用来衡量癌症是否会扩散的重要指标,说明治疗后患者血液中的癌细胞数量减少了超过50%;
肿瘤细胞聚集团(CTC clusters)也明显减少,意思是那些成群结队的癌细胞也明显减少了;
剩余循环肿瘤细胞(CTCs)中,间充质型细胞比例下降,这是蕞容易转移、蕞难治的癌细胞类型之一。
这些结果表明,这套联合治疗方案已经在早期对癌细胞的传播起到了明显抑制作用,有望强效抑制肿瘤细胞向全身扩散。
来源:ChatGPT生成AI示意图
这位患者的早期治疗效果,与之前发表在《Molecular Cancer Therapeutics》杂志上的动物实验研究数据高度一致。那项研究发现,当Paxalisib与免疫疗法联合使用时,可以有效减少血液中的癌细胞数量,不管是单个的还是成团的,同时还能抑制其扩散能力。
患者数据的临床意义
肿瘤细胞聚集团(CTC clusters)一直被认为是癌症转移的“关键推手”,也是预示病情凶险的重要标志。它们能抵抗细胞凋亡(自然死亡),逃避免疫攻击,并以极高效率扩散到身体其他部位形成新的肿瘤。
已有研究发现,传统化疗在初期可能会暂时升高循环肿瘤细胞(CTC)的数量,甚至在头一个疗程结束时出现翻倍现象,随后在第二周期后才会下降。而免疫治疗单独使用时,因其是“慢启动”的机制,往往需要几周甚至几个月才见效,对循环肿瘤细胞(CTC)的清除也比较有限。
但这次试验中,联合使用Paxalisib与免疫治疗,仅21天就让循环肿瘤细胞(CTC)总数和肿瘤细胞聚集团(CTC clusters)都快速下降,并且连“蕞难缠”的间充质型细胞也减少了。这种多重效果,是以往单用化疗或免疫治疗短期内很难达成的,表明这一组合方案在机制上具有协同效应,契合此前的动物实验结果。
专家评论
Kazia Therapeutics公司首席执行官Dr. John Friend表示:“看到我们此前大量实验室研究能够成功转化为这名患者的早期积极数据,令人无比振奋。在短短21天内,肿瘤细胞传播标志物就出现大幅下降,这让我们对整个临床试验充满信心。”
他还补充道:“肿瘤细胞聚集团(CTC clusters)是癌细胞扩散的‘超级部队’,其转移效率是单个循环肿瘤细胞(CTC)的20-100倍。现在它们锐减的情况非常鼓舞人心,我们相信这种组合治疗有望成为阻止癌症全身扩散的有效早期干预方案。”
下一步计划
进一步研究循环肿瘤细胞(CTC)变化与影像学疗效(如肿瘤缩小)的关系;
1b期临床试验继续招募患者,扩大样本量以评估安全性、耐受性和药效;
对所有患者进行动态监测,包括免疫微环境与循环肿瘤细胞(CTC)变化的综合分析;
长期跟踪数据将包括影像学评估、无进展生存期(PFS)和与分子生物标志物的关联性研究。
Paxalisib是一款什么药?
Paxalisib是一种可穿透血脑屏障的PI3K/Akt/mTOR通路抑制剂,正用于多种癌症的治疗研发。
Paxalisib目前已在胶质母细胞瘤等疾病中进行过10项临床试验。
关于Kazia Therapeutics公司一项重要的2/3期GBM-Agile试验已于2024年完成,公司正与监管机构商讨启动注册性研究,以争取正式上市。
除胶质瘤外,Paxalisib也在晚期乳腺癌、脑转移瘤、弥漫性中线胶质瘤(DMG)和原发性中枢神经系统淋巴瘤等疾病中开展临床试验,其中多项试验已报告积极中期数据。
美国食品药品监督管理局(FDA)曾于2018年授予Paxalisib孤儿药资格,用于胶质瘤;
2020年授予其快速通道资格,用于胶质瘤;
2023年7月,该药在联合放疗治疗带有PI3K突变的脑转移瘤时,也获快速通道资格;
2020年8月,获得针对弥漫性桥脑胶质瘤(DIPG)的孤儿药资格和儿童罕见病资格;
2022年6月和7月,获得针对非典型畸胎瘤/横纹样瘤(AT/RT)的孤儿药资格和儿童罕见病资格。
来源:
https://www.prnewswire.com/news-releases/kazia-therapeutics-reports-early-efficacy-data-from-first-triple-negative-breast-cancer-patient-receiving-paxalisib-combination-regimen-achieving-50-reduction-in-circulating-tumor-cells-in-phase-1b-trial-302500778.html
【盛诺一家】成立于2011年,是国内领先的海外医疗咨询服务机构,至今已为近10000个患者家庭提供出国就医服务,重点涵盖癌症、心脏病、罕见疾病等重疾领域。凭借专业、贴心、高效的服务,盛诺一家赢得了99%客户好评率!
📌为什么出国就医患者选择盛诺一家?
- 官方资质:与美国、日本、英国近50家TOP级医院签署官方合作协议,搭建全球医疗服务网络
- 专业可靠:咨询服务团队成员70%拥有医学背景,包括医学院博士、三甲医院医生、资深医学翻译
- 一站式服务:在全球设有15个客户服务中心,保障从国内到海外全流程、高品质的服务质量
- 客户至上:推出48小时冷静期、风险告知书、医疗费用“零加成”等措施,保障客户权益
- 专属折扣:通过本公司预约出国就医的患者,可额外申请5%–40%的医疗费用减免折扣
👉如果您或者家人需要出国看病,可拨打免费咨询热线 400-855-7089,或通过 盛诺一家官网 预约咨询!








