摘要
美国食品药品监督管理局(FDA)授予前沿药67Cu-SAR-bisPSMA快速通道认证,用于治疗已接受过雄激素受体通路抑制(ARPI)治疗的前列腺特异性膜抗原(PSMA)阳性转移性去势抵抗性前列腺癌(mCRPC)成人患者。
67Cu-SAR-bisPSMA是由澳大利亚Clarity Pharmaceuticals公司开发的一款创新型药物。
FDA的快速通道认定旨在加速治疗严重疾病且存在重大未满足医疗需求的新药物的开发和监管审查。雄激素受体通路抑制(ARPI)治疗通过阻止雄激素与其受体结合,减少雄激素对前列腺癌细胞的刺激,从而抑制癌细胞的生长。前列腺特异性膜抗原(PSMA)阳性意味着前列腺癌细胞表面存在一种叫做PSMA的特定蛋白,可以通过影像学检查或其他检测手段被发现。PSMA阳性通常表明癌细胞具有特定的标志物,有助于靶向治疗。转移性去势抵抗性前列腺癌(mCRPC)是指前列腺癌已经扩散到身体的其他部位(转移),并且在去势治疗(降低雄激素水平)后,癌症仍然继续生长和扩散。这种类型的前列腺癌对传统的去势治疗不再有效,通常需要更强的治疗手段。
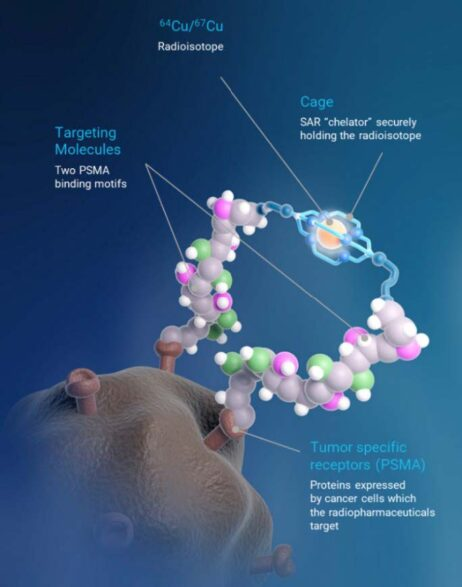
来源:Clarity Pharmaceuticals公司官网此次认证基于1/2a期SECuRE试验(NCT04868604)的初步数据。该研究旨在评估67Cu-SAR-bisPSMA的安全性和疗效。试验中的前三个剂量递增组已经成功完成。SECuRE试验是一项开放标签、非随机研究,招募了年龄至少18岁的转移性去势抵抗性前列腺癌(mCRPC)患者,这些患者在接受过雄激素剥夺治疗(一种治疗前列腺癌的方法,通过降低体内雄激素(如睾酮)的水平来抑制癌细胞的生长)和至少1次雄激素受体通路抑制(ARPI)治疗后病情继续进展。研究要求患者接受64Cu-SAR-bisPSMA(一种用于前列腺癌影像学检查的放射性药物)PET/CT扫描呈阳性。其他主要纳入标准包括ECOG性能状态为0至2(意味着身体状况基本良好),预计生存期超过6个月,至少有1个转移性病灶,且器官功能良好。如果患者有脑转移、小细胞或神经内分泌型前列腺癌的组织学诊断,或在4周内有过深静脉血栓或肺栓塞病史,则将被排除。在试验的剂量递增部分,患者至多可接受2次67Cu-SAR-bisPSMA治疗;在队列扩展阶段,患者将根据剂量递增部分的推荐剂量接受2次治疗。该试验的主要终点包括67Cu-SAR-bisPSMA的生物分布和剂量学(在患者体内的分布情况以及它的安全性和剂量对患者的影响),确定67Cu-SAR-bisPSMA的蕞大耐受剂量和推荐的2期剂量,以及初步疗效。SECuRE试验纳入的大多数入组患者(77%)存在骨转移,入组前列腺特异性抗原(PSA,前列腺癌的主要肿瘤标志物之一)水平较高,且接受过大量治疗(59%的患者接受了3种或更多治疗方案)。- 在所有剂量递增队列中,73%的可评估患者,PSA水平出现下降。
- 在接受治疗的患者中,45%的患者PSA下降超过50%,其中部分患者仅接受了1次67Cu-SAR-bisPSMA的4、8或12 GBq剂量。
- 在2、3和4组队列中,患者分别接受了8 GBq单次剂量、12 GBq单次剂量和12 GBq多次剂量的67Cu-SAR-bisPSMA治疗。在这些队列中,约75%的患者PSA下降超过35%,近一半的患者PSA下降至少80%。
该试验目前正在进入蕞高剂量组,参与者接受了12 GBq多次剂量的67Cu-SAR-bisPSMA治疗。第4组队列的患者招募已经完成。该队列中的3名患者已接受了2次研究治疗,并且正在进行安全性和疗效随访。完成随访期后,安全性审查委员会预计将在2025年3月召开会议。- 截至目前,4组中PSA降幅蕞大的一名患者,PSA下降了98%。该患者在接受67Cu-SAR-bisPSMA治疗之前已经接受多种治疗均失败。
- 研究者对患者的肿瘤进行了放射学检查,并评估出肿瘤有所缩小,达到了部分缓解(PR),意味着肿瘤缩小了30%。
- 此外,通过影像评估,患者的肿瘤体积减少了60.6%(见下图)。
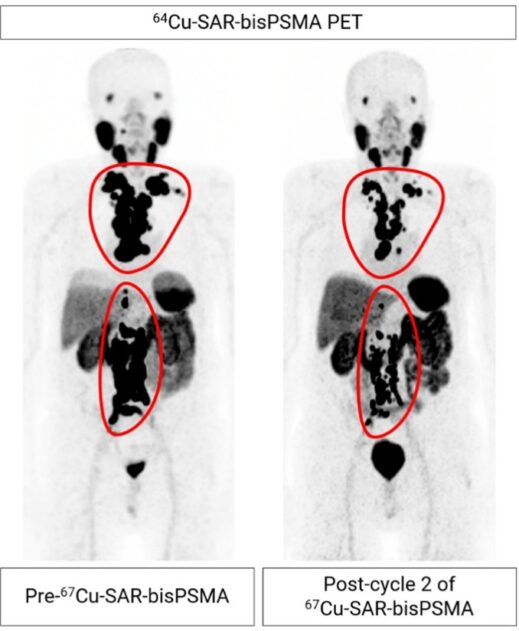
来源:Clarity Pharmaceuticals公司官网- 试验的前三个队列未报告剂量限制性毒性(DLTs)。
- 大多数与67Cu-SAR-bisPSMA相关的不良事件(AEs)主要为1级或2级(比较轻微)。
Clarity Pharmaceuticals公司执行主席Alan Taylor博士在新闻发布中表示:“在过去6个月内,我们的两项SAR-bisPSMA产品(64Cu-SAR-bisPSMA和67Cu-SAR-bisPSMA)获得了3项快速通道认证,这是一个令人难以置信的成就,彰显了我们的科学和研发成果的卓越性,突显了前列腺癌治疗和诊断中仍然存在的巨大未满足需求。SAR-bisPSMA是澳大利亚科学的结晶,旨在克服现有PSMA靶向产品的一些不足。通过优化两个PSMA配体,它不仅能让药物在肿瘤部位积累更多,还能使药物在肿瘤处停留更长时间,因此成为了理想的诊断和治疗工具。我们在诊断和治疗方面的临床数据非常出色,证明了我们在早期临床研究中取得的积极成果。”67Cu-SAR-bisPSMA的另外两项3期注册试验(CLARIFY [NCT06056830]和AMPLIFY)正在进行中。来源:
[1]https://www.onclive.com/view/67cu-sar-bispsma-earns-fda-fast-track-designation-for-psma-mcrpc
[2]https://www.claritypharmaceuticals.com/news/ftd-67cu-sarbispsma/
【盛诺一家】成立于2011年,是国内领先的海外医疗咨询服务机构,至今已为近10000个患者家庭提供出国就医服务,重点涵盖癌症、心脏病、罕见疾病等重疾领域。凭借专业、贴心、高效的服务,盛诺一家赢得了99%客户好评率!
📌为什么出国就医患者选择盛诺一家?
- 官方资质:与美国、日本、英国近50家TOP级医院签署官方合作协议,搭建全球医疗服务网络
- 专业可靠:咨询服务团队成员70%拥有医学背景,包括医学院博士、三甲医院医生、资深医学翻译
- 一站式服务:在全球设有15个客户服务中心,保障从国内到海外全流程、高品质的服务质量
- 客户至上:推出48小时冷静期、风险告知书、医疗费用“零加成”等措施,保障客户权益
- 专属折扣:通过本公司预约出国就医的患者,可额外申请5%–40%的医疗费用减免折扣
👉如果您或者家人需要出国看病,可拨打免费咨询热线 400-855-7089,或通过 盛诺一家官网 预约咨询!
本文为海外就医科普文章,内容仅供阅读参考,不作为任何疾病治疗的指导意见。文章由盛诺一家编译,版权归盛诺一家公司所有,转载或引用本网内容须注明“转自盛诺一家官网(www.stluciabj.cn)”字样。










